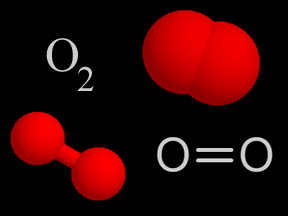
Óxidos de nitrógeno - óxido nítrico (NO) y dióxido de nitrógeno (NO2)
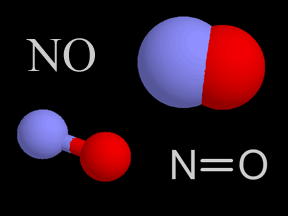
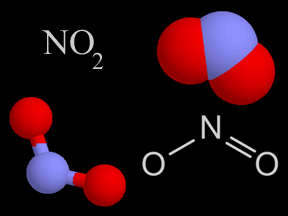
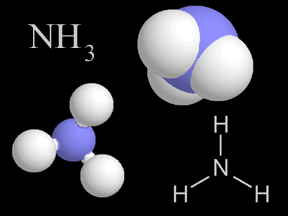
El óxido nítrico (NO) y el dióxido de nitrógeno (NO2) son dos gases cuyas moléculas están compuestas por átomosde nitrógeno y oxígeno. Estos óxidos de nitrógeno contribuyen al problema de la contaminación del aire, actuando en la formación del smog y de la lluvia ácida. Son liberados en la atmósfera terrestre por fuentes naturales y artificiales. El óxido nítrico es un gas incoloro e inflamable de olor suave. El dióxido de nitrógeno es un gas de intenso color rojo anaranjado, venenoso pero no inflamable. Éste, junto con los aerosoles, le da el color café rojizo al smog. En altas concentraciones es sumamente tóxico y puede causar serios daños pulmonares. El dióxido de nitrógeno es un fuerte agente oxidante y, por esto, muy reactivo con otros compuestos. Los científicos estiman que la naturaleza produce anualmente entre 20 y 90 millones de toneladas de óxido de nitrógeno en la Tierra. Las fuentes naturales comprenden volcanes, océanos, desechos biológicos y rayos. Las actividades humanas suman otros 24 millones de toneladas de óxidos de nitrógeno a nuestra atmósfera anualmente. Tanto el NO como el NO2 se forman durante combustión a altas temperaturas en la atmósfera, cuando el oxígeno se combina con el nitrógeno. El gas de escape de autos y camiones, al igual que las emisiones de las plantas generadoras de energía eléctrica, son la fuente principal de los óxidos de nitrógeno. El escape de los automóviles tiene más NO que NO2, pero una vez que el NO es liberado a la atmósfera, rápidamente se combina con el oxígeno del aire para formar NO2. Los óxidos de nitrógeno son, al menos en parte, responsables de diversos tipos de contaminación del aire. El dióxido de nitrógeno da el color a esa neblina café rojiza que llamamos smog. La fotodisociación del dióxido de nitrógeno por la luz solar produce óxido nítrico y ozono en la troposfera , el cual es otro componente del smog. Una serie de reacciones químicas transforman los componentes orgánicos volátiles (COV) en sustancias que se combinan con dióxido de nitrógeno para producir PAN (peroxiacetilnitrato), otro elemento más del smog. El dióxido de nitrógeno en el aire también reacciona con el vapor de agua para formar ácido nítrico, una de las clases de ácido de la lluvia ácida. La concentración de óxido nítrico en aire sin contaminación es de alrededor de 0.01 ppm (partes por millón). En el smog, las concentraciones se elevan a alrededor de veinte veces más, a 0.2 ppm. Aunque los óxidos de nitrógeno han ganado una dudosa distinción como contaminantes, también se utilizan de manera beneficiosa en algunos procesos industriales. El óxido nítrico se fabrica a gran escala y, posteriormente, se usa para hacer ácido nítrico (HNO3). Para crear óxido nítrico para usos industriales, los químicos combinan amoníaco (NH3) con oxígeno (O2), liberando agua (H2O) como producto derivado. Los componentes del nitrógeno derivados del ácido nítrico se utilizan para crear fertilizantes químicos, explosivos y otras sustancias de gran utilidad. |