Los enlaces en color gris lo llevan a páginas en Inglés aún no traducidas al Español.
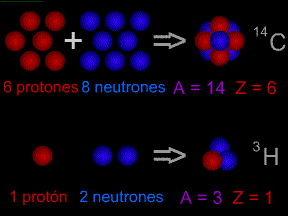
Esta imagen ilustra las ideas de "número atómico" y "
masa atómica". El
núcleo del átomo de carbono (
14C), que aparece en la parte superior, tiene 6
protones y 8
neutrones, resultando en una masa atómica de 6 (número de protones). Su masa atómica es 14 (número de protones más número de neutrones). El Tritio (
3H), un
isótopo de hidrógeno, se muestra en la parte inferior. Tiene 1 protón y 2 neutrones en su núcleo. El tritio tiene un número atómico de 1 y una masa atómica de 3.
Haz "click" en la imagen para una vista completa
Trabajo original de (Randy Russell), miembro del equipo de Ventanas al Universo.
Masa Atómica
Una de las formas como los científicos miden el tamaño de algo es a través de su masa. La masa es algo parecido al peso. Los científicos pueden medir cosas muy minúsculas como los átomos. La medida del tamaño de un átomo es "masa atómica". Casi toda la masa de un átomo (más del 99%) está en su núcleo. La "masa atómica" es realmente una medida del tamaño del núcleo de un átomo.
El núcleo de un átomo se compone de protones y neutrones. Los protones y los neutrones son casi exactamente del mismo tamaño. Si se suma el número de protones y de neutrones en el núcleo de un átomo, se obtiene la masa atómica del átomo. Un simple átomo de hidrógeno tiene tan solo un protón y cero neutrones. Su masa atómica es 1. La clase más común de átomo de carbono tiene 6 neutrones y 6 protones. Tiene una masa atómica de 12.
Todos los átomos de un elemento determinado, tienen el mismo número de protones. Los átomos de oxígeno siempre tienen 8 protones. Los átomos de carbono todos tienen 6 protones. El número de protones es llamado por los científicos "número atómico". Los científicos utilizan la letra "Z" para denotar el número atómico y la letra "A" para denotar la masa atómica.
La mayoría de los átomos vienen en diversos tipos llamados isótopos. Los isótopos tienen diversos números de neutrones. El isótopo más común de carbono tiene 6 neutrones y 6 protones. Su masa atómica es 12. Un raro isótopo radiactivo de carbono tiene 8 neutrones. Su masa atómica es 14 (6 protones + 8 neutrones).
Pudiera también interesarle:
Cada átomo tiene un núcleo. El núcleo contiene protones y neutrones. Los científicos tienen un nombre especial para el número de protones en un átomo. Lo llaman "número atómico". Hay casi 100 elementos
...más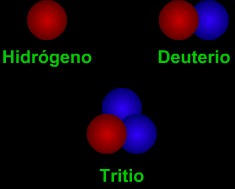
Los isótopos son diversas "versiones" de un elemento. Todos los átomos de un elemento tienen el mismo número de protones. Todos los átomos de hidrógeno tienen un protón, todos los átomos de carbón tienen
...más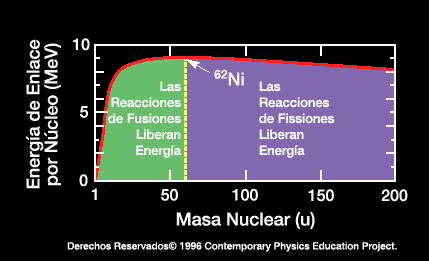
Una gráfica del enlace energético por nucleón contra la masa atómica muestra un número atómico máximo de 56 (Hierro). Los elementos con una masa atómica menor de 56 desprenden energía si se forman como
...más
¿Buscando contenido en línea que pueda ser usado para un curso o módulo educativo sobre cambio climático? Las páginas enlazadas a continuación pueden ser usadas como apoyo a una unidad o curso introductorio
...más
Aún no hemos desarrollado el texto de este nivel. Si deseas saber más acerca de este tema, por favor ve a la página de "Intermedio". Para ir al nivel "Intermedio" por favor pulsa sobre el botón "Intermedio"
...más
Una de las formas como los científicos miden el tamaño de algo es a través de su masa. La masa es algo parecido al peso. Los científicos pueden medir cosas muy minúsculas como los átomos. La medida del
...más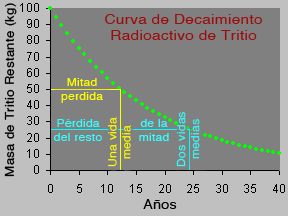
Algunos materiales son radiactivos. Sus átomos emiten radiación. Cuando un átomo emite radiación, se convierte en un tipo de átomo diferente. Eso se llama decaimiento radioactivo. Algunos átomos decaen
...más













