Haz "click" en la imagen para una vista completa
Trabajo original del miembro del equipo de Ventanas al Universo (Randy Russell).
Isótopo
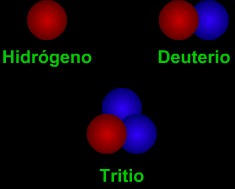
Los isótopos son diversas "versiones" de un elemento químico. Todos los átomos de un elemento tienen el mismo número de protones. Por ejemplo, todos los átomos de hidrógeno tienen un protón, todos los átomos de carbón tienen seis protones, y todos los átomos de uranio tienen 92 protones. Sin embargo, el número de neutrones en átomos de un elemento puede variar. Por ejemplo, mientras que la mayoría de los átomos de carbón tienen seis neutrones, cerca de 1% de los átomos de carbón encontrados en la Tierra tienen siete neutrones y una fracción más pequeña de átomos de carbón tienen ocho neutrones. Todos los átomos de carbón tienen un número atómico (número de protones) de seis, pero los diversos isótopos del carbón pueden tener una masa atómica (número de protones + neutrones) de 12, 13 ó 14.
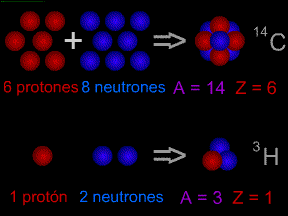
Dos tipos de notación son de uso general para señalar isótopos. Por ejemplo, el isótopo de carbónde de 8 neutrones se escribe como carbono-14 ó 14C. En general, todos los isótopos de un elemento particular se comportan de la misma manera en reacciones químicas. Por ejemplo, un átomo del raro isótopo oxígeno-18, se combinará fácilmente con dos átomos de hidrógeno para formar agua (H2O) cmo ocurriría con el común átomo oxígeno-16.
Algunos isótopos son radiactivos, mientras otros no lo son. Los átomos de isótopos radiactivos pueden "descomponerse" emitiendo energía a modo de cierto tipo de radiación. Los átomos que se descomponen, típicamente pierden uno o más protones y/o neutrones, convirtiendo el átomo en una especie diferente de isótopo, e incluso en un elemento diferente. Los isótopos que no son radiactivos se llaman isótopos "estables". De los 94 elementos que ocurren de forma natural en la Tierra, 80 tienen por lo menos un isótopo estable. Hay 26 elementos que sólo tienen un isótopo estable. El estaño tiene la mayoría, con diez isótopos estables. De los 80 elementos con al menos un isótopo estable, el número medio de isótopos estables es 3.2 por elemento.
Las tablas que enumeran las masas atómicas de elementos consideran la abundancia relativa de cada isótopo. Por ejemplo, la masa atómica del cloro se reporta como 35.5 puesto que el 76% del cloro encontrado en la Tierra es el más ligero 35Cl, mientras que el 24% es el más pesado 37Cl. ¿De dónde provienen estos diversos isótopos, y por qué hay diferentes cantidades de cada uno en la naturaleza? Los astrónomos creen que los únicos elementos creados en el Big Bang, eran varios isótopos de hidrógeno, de helio, y probablemente de litio, berilio y boro. Desde entonces, las enormes explosiones de supernovas han creado los elementos restantes, incluyendo la mayoría de sus isótopos. Algunos isótopos se forman cuando los rayos cósmicos de gran energía chocan contra los varios átomos. Los isótopos también se crean cuando otros isótopos radiactivos se descomponen.
Los isótopos con frecuencia ofrecen a los científicos información sobre la historia de procesos naturales. Las técnicas de href="/physical_science/physics/radiocarbon_dating.html&edu=high&lang=sp&dev=1/windows.html" class=outlink>datación de carbono nos ayudan a determinar la edad de los objetos, basados en la relativa abundancia del 12C estable con respecto al 14C radiactivo (que decae y "desaparece" con el tiempo). La razón de deuterio contra átomos de hidrógeno normales en moléculas de agua en muestras de núcleo de hielo, nos ayuda a estimar temperaturas globales del pasado; las moléculas de un agua levemente más pesada que contienen un átomo de deuterio se evaporan de los océanos (y nieve posterior sobre los polos) a una tasa diferente con respecto a sus primos naturales de hidrógeno, indicando las temperaturas promedias.